En el año 1865 médico y fisiólogo, creador de la escuela francesa de la fisiología experimental, compilo y publico su “An Introduction to the Study of Experimental Medicine” recogiendo sus trabajos sobre décadas de investigación acerca de la regulación de las condiciones en las cuales funciona el cuerpo humano (1). El cuerpo humano y el de otros seres vivos complejos es capaz de adaptarse al medio ambiente y las condiciones físico químicas en el cual se encuentra, modificando el funcionamiento de los distintos sistemas corporales: los grandes vertebrados son capaces de mantener sus condiciones internas incluso cuando las condiciones externas podrían modificarlas (2). De sus postulados dos conceptos son de alta relevancia, por una parte, el concepto de regulación y por el otro el de armonía para el funcionamiento. Sin duda estas ideas sentaron las bases para el entendimiento del funcionamiento del cuerpo.
Entre los años 1920 y 1930, Walter Cannon, renombrado fisiólogo, publico sus trabajos sobre el funcionamiento del cuerpo, acuñando el término de homeostasis, es decir, la capacidad de los organismos para mantener una condición interna a pesar de los cambios que ocurran en el ambiente externo (3,4). Sus aportes permitieron el entendimiento de ciertas condiciones en las cuales el microambiente celular se regula para lograr su funcionamiento óptimo: temperatura, concentraciones de iones, presión osmótica y nutrientes (5).
A pesar de ello, sólo hasta la década de los 60´s con la publicación del trabajo de Arthur Guyton, muchos profesionales en todo el mundo entendieron la homeostasis como un proceso activo del cuerpo y las implicaciones en el contexto de la salud y la enfermedad (6).
Homeostasis, salud y enfermedad
La homeostasis es por definición el conjunto de procesos corporales mediante los cuales se mantiene el equilibrio a pesar de los cambios que ocurran (7). Son varias las características de la homeostasis:
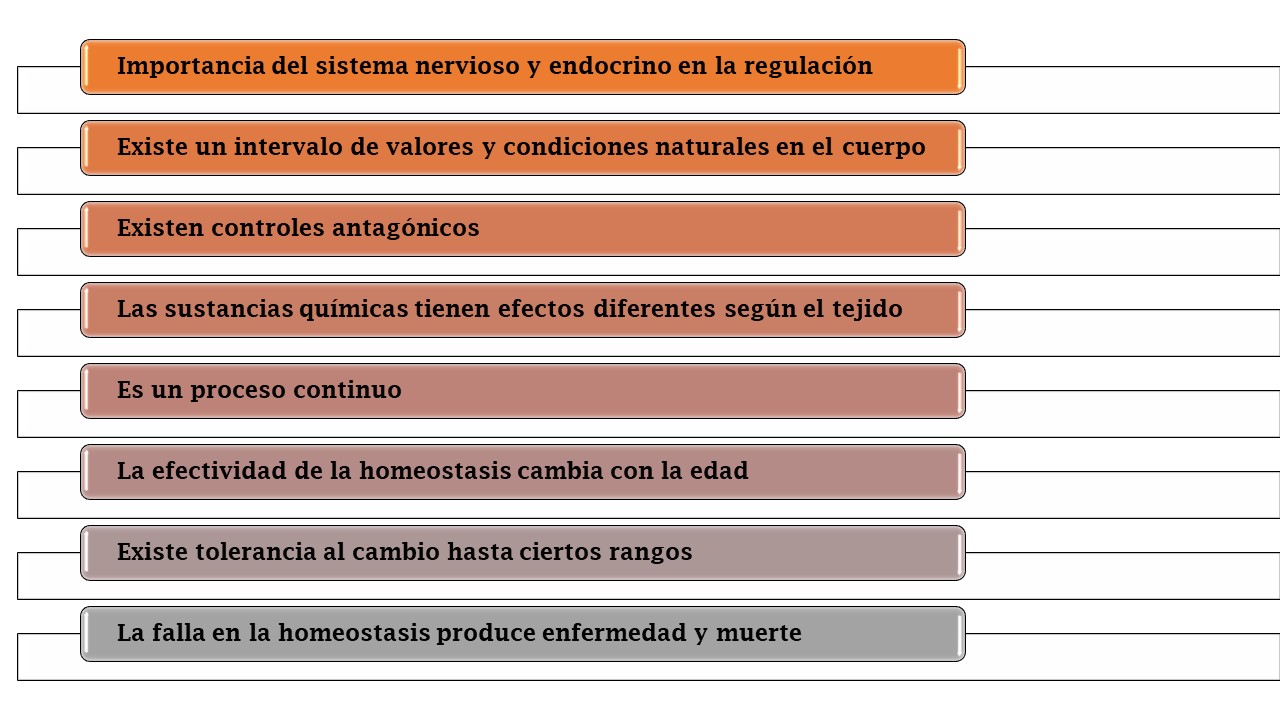
Dentro de la regulación de la homeostasis son trascendentales los mecanismos de retroalimentación positiva, negativa y anteroalimentación. Todas las funciones del cuerpo, sistémicas y celulares, poseen este tipo de regulación, por supuesto, se trata de mecanismos complejos (8). Si bien en principio el análisis de los procesos de la homeostasis se realizaron desde un punto de vista anatómico, cada vez se comprenden mejor los mecanismos moleculares y genéticos que se encuentran detrás de las regulación de estos (9).
Son muchas y diversas las enfermedades que ocurren como consecuencia de la alteración de los mecanismos homeostáticos del cuerpo, uno de los más estudiados es la homeostasis de los macrófagos. La alteración de la homeostasis en estas células bien sea por efecto de la edad, por alteraciones epigenéticas o por otros agentes modificadores de la expresión genética esta relacionado con la aparición de la osteoporosis, fibrosis hepática e hígado graso, aterosclerosis, obesidad, artritis y cáncer (10).
Alostasis y sobrecarga adaptativa
Hacia los años 1930 se produjeron por primera vez las descripciones de lo que ocurre en el cuerpo en situaciones extremas: se trata de la primera respuesta del síndrome de estrés o síndrome de adaptación general, es decir, todas aquellas manifestaciones clínicas derivadas del intento de adaptación a los cambios (11,12).
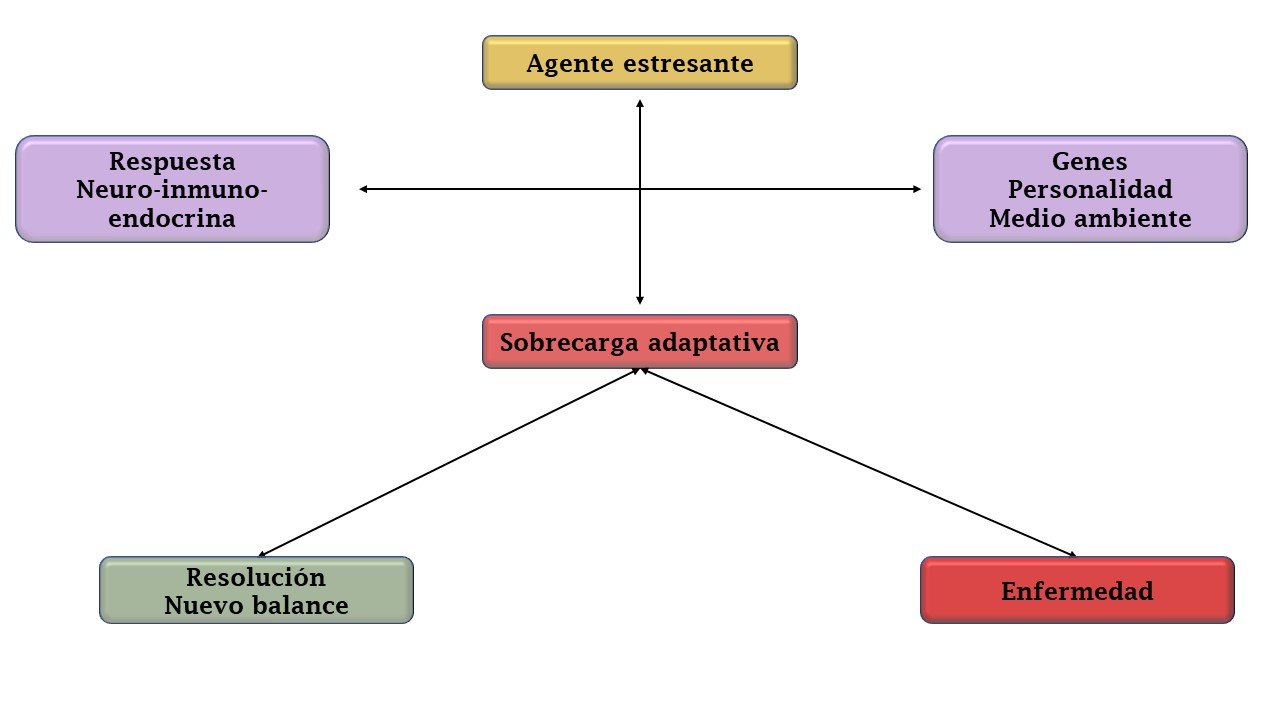
Más recientemente, Peter Sterling y Bruce McEwen, introducen un nuevo concepto, diametralmente diferente del de la homeostasis, la alostasis. La alostasis es la estabilidad a través del cambio, es decir, el objetivo de la regulación no es mantener la constancia sino alcanzar la adaptación manteniendo la aptitud física (13). Los cambios de las condiciones medioambientales y de funcionamiento de un organismo obligan al cuerpo a realizar modificaciones en su funcionamiento para ser eficientes, minimizar el error y minimizar sus costo, es decir, desde esta perspectiva los valores “anormales” en un parámetro fisiológico son una señal de la búsqueda de adaptación a nueva condición (14).
Así las cosas, pueden diferenciarse claramente dos tipos de sistemas, aquellos vitales que no tienen un alto margen de variación (como el pH y la osmolaridad) y los alostáticos que tienen un gran margen de variación y contribuyen a mantener la homeostasis mediante el cambio de sus propios parámetros (15–17). Los mejores ejemplos de sistemas activados mediante la alostasis son el eje hipotálamo-pituitario-adrenal y el sistema nervioso autónomo (18).
Como cualquier sistema corporal estos mecanismos de adaptación pueden saturarse, o su activación continua podría producir efectos sobre los órganos y células. La alteración, desgaste y deterioro que ocurre como consecuencia de la respuesta adaptativa continua es conocida como sobrecarga alostática o sobrecarga adaptativa (19).
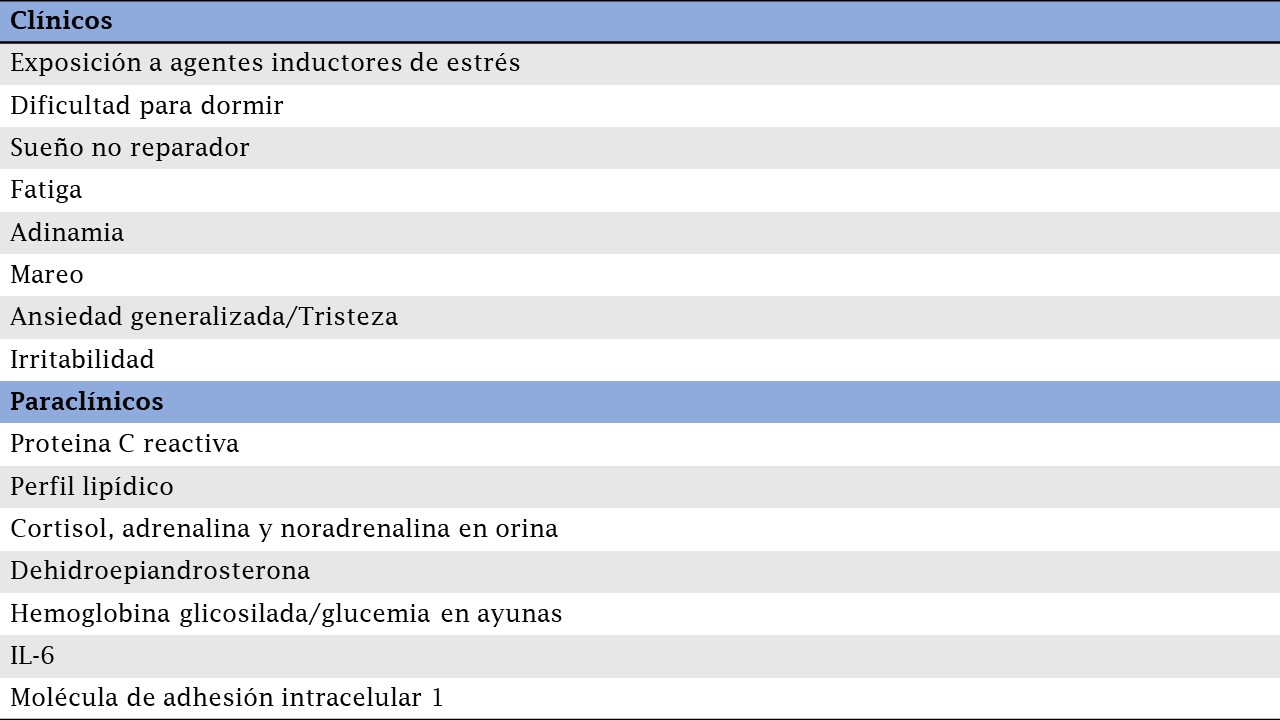
No existe una definición de sobrecarga adaptativa definida mediante criterios estandarizados. Sin embargo existen criterios clínicos y paraclínicos que pueden asumirse como marcadores de sobrecarga adaptativa (20):
Los mecanismos mediante los cuales la necesidad de lograr la adaptación produce enfermedad son múltiples y comenzaron recientemente a ser comprendidos:
- Elevación crónica de los niveles de cortisol (21)
- Alteración de la función mitocondrial (22)
- Pérdida de la regulación de los mecanismos epigenéticos (23)
- Estrés oxidativo (24)
- Anormalidad en la expresión genética (25)
- Acortamiento de los telómeros/incremento de la actividad de la telomerasa (26)
Todos estos mecanismos, por supuesto, se traducen en la alteración funcional de diferentes estructuras, una de las más importantes el sistema nervioso central. La modificación de las estructuras corticales, alteración de liberación hormonal y la ruptura de la comunicación con el sistema inmunológica son los eventos iniciales que conducen al deterioro progresivo de la función celular (28).
Un buen ejemplo de cómo la sobrecarga adaptativa produce enfermedad es la fibromialgia (29). La hiperreactividad del eje hipotálamo-pituitario-adrenal es en buena medida responsable de las alteraciones funcionales de la enfermedad, así como de las manifestaciones sintomáticas de la enfermedad. La sobrecarga adaptativa ha mostrado también estar relacionada con el desarrollo de enfermedades psiquiátricas del estado de ánimo como la depresión y la ansiedad (30). En estos casos los mediadores de la respuesta de adaptación producen anomalías en la liberación de la serotonina, dopamina y noradrenalina en las áreas corticales que se encargan de la regulación del estado de ánimo.
La homeostasis y alostasis como objetivos terapéuticos de la apiterapia
Es evidente que la ausencia de homeostasis produce enfermedad y que la respuesta alostática sostenida en el tiempo produce sobrecarga que también esta relacionada con la enfermedad. Esta última, particularmente, es importante en las enfermedades crónicas y degenerativas. Probablemente muchos de las personas que padecen una de estas enfermedades (como la artrosis, artritis y el cáncer) tienen como parte de su proceso fisiopatológico la sobrecarga adaptativa y alteración de la homeostasis en los tejidos enfermos. La apiterapia ejerce acciones moduladoras de los eventos relacionados con la alteración de la homeostasis y la sobrecarga adaptativa:
Efectos de la elevación crónica del cortisol. Los principales efectos de la elevación del cortisol se dan principalmente en el sistema nervioso central donde se altera la neurogénesis y plasticidad sináptica. La jalea real y miel de abejas poseen efectos favorables que protegen las neuronas de la muerte prematura e inducen la neurogénesis (31–34). Adicionalmente la jalea real ha mostrado disminuir los niveles de cortisol en modelos animales de estrés crónico (33).
Alteración de la función mitocondrial. El veneno de abejas es uno de los productos de la colmena que protege la función mitocondrial, particularmente cuando esta se altera como consecuencia de la acción del factor de crecimiento transformante beta; bloquea el daño del ADN mitocondrial y la inducción de la vía de las caspasas (35). La miel de abejas evita la activación de la vía de las caspasas y la disfunción mitocondrial inducida por especies de oxígeno reactivo previniendo el daño del ADN (36). Ante un ambiente de hiper activación de la mitocondria, como ocurre en el entrenamiento físico, la jalea real facilita la adaptación de la mitocondria al incremento de su función mediante la inducción de la biogénesis mitocondrial (37).
Pérdida de la regulación de los mecanismos epigenéticos. La metilación del ADN es uno de los mecanismos epigenéticos envueltos en el desarrollo de enfermedades crónicas y degenerativas. El veneno de abejas tiene la capacidad de producir la desmetilación de regiones promotoras de la expresión de genes relacionados con la supervivencia celular (38). El propóleo por su parte previene la metilación del ADN (39).
Estrés oxidativo. La jalea real, propóleo, miel y polen de abejas poseen la capacidad de secuestrar especies de oxígeno reactivo y prevenir el daño de las células y tejidos inducido por el estrés oxidativo (40–44).
Anormalidad en la expresión genética. El veneno de abejas, propóleos y jalea real modulan la expresión genética mediante efectos sobre el factor nuclear kappa-beta (45–48). La activación de este factor nuclear es un evento fisiopatológico en todas las enfermedades crónicas y degenerativas y su actividad alterada conduce a la modificación en la expresión de genes relacionados con la supervivencia celular, inflamación y producción de proteinas estructurales (49,50).
Acortamiento de los telómeros/incremento de la actividad de la telomerasa. El consumo regular de productos de la colmena como la miel, polen y propóleo reduce la velocidad con la cual se produce el acortamiento de los telómeros, indicador de envejecimiento celular (50).
Puede apreciarse entonces que los productos de la colmena producen impacto sobre los diferentes mecanismos implicados en la aparición de enfermedades derivadas de la alteración de la homeostasis y la sobrecarga adaptativa. No debe olvidarse impactar sobre ellos en la terapéutica de las enfermedades, especialmente aquellas crónicas y degenerativas.
Si te gustó este artículo te invitamos a compartirlo y suscribirte en el link «Newsletter» para recibir más información y contenidos relacionados
Referencias bibliográficas
1. Bernard C. Introduction a? l’e?tude de la me?decine expe?rimentale. Introduction a? l’e?tude de la me?decine expe?rimentale. 2003.
2. Bernard C, Bert P, Dastre A, Vulpian A. Leçons sur les phénomènes de la vie communs aux animaux et aux végétaux … Leçons sur les phénomènes de la vie communs aux animaux et aux végétaux … 2011.
3. Washburn MF, Cannon WB. Bodily Changes in Pain, Hunger, Fear, and Rage. J Philos Psychol Sci Methods. 1917;
4. Cannon WB. ORGANIZATION FOR PHYSIOLOGICAL HOMEOSTASIS. Physiol Rev. 1929;
5. Cooper SJ. From Claude Bernard to Walter Cannon. Emergence of the concept of homeostasis. Appetite. 2008.
6. Modell H, Cliff W, Michael J, McFarland J, Wenderoth MP, Wright A. A physiologist’s view of homeostasis. Adv Physiol Educ [Internet]. 2015 Dec;39(4):259–66. Available from: https://www.physiology.org/doi/10.1152/advan.00107.2015
7. Kotas ME, Medzhitov R. Homeostasis, Inflammation, and Disease Susceptibility. Cell. 2015.
8. Klein S, Zion M. The characteristics of homeostasis: a new perspective on teaching a fundamental principle in biology. Sch Sci Rev. 2015;
9. Siebel C, Lendahl U. Notch Signaling in Development, Tissue Homeostasis, and Disease. Physiol Rev [Internet]. 2017 Oct 1;97(4):1235–94. Available from: https://www.physiology.org/doi/10.1152/physrev.00005.2017
10. Wynn TA, Chawla A, Pollard JW. Macrophage biology in development, homeostasis and disease. Nature [Internet]. 2013 Apr 24;496(7446):445–55. Available from: http://www.nature.com/articles/nature12034
11. Tan SY, Yip A. Hans Selye (1907-1982): Founder of the stress theory. Singapore Medical Journal. 2018.
12. Rochette L, Vergely C. Hans Selye and the stress response: 80 years after his “letter” to the Editor of Nature. Annales de Cardiologie et d’Angeiologie. 2017;
13. Sterling P. Allostasis: A model of predictive regulation. Physiol Behav [Internet]. 2012 Apr;106(1):5–15. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0031938411003076
14. McEwen BS, Wingfield JC. The concept of allostasis in biology and biomedicine. Horm Behav [Internet]. 2003 Jan;43(1):2–15. Available from: http://www.ncbi.nlm.nih.gov/pubmed/12614627
15. McEwen BS. Mood disorders and allostatic load. Biol Psychiatry [Internet]. 2003 Aug 1;54(3):200–7. Available from: http://www.ncbi.nlm.nih.gov/pubmed/12893096
16. McEwen BS. Allostasis and allostatic load: implications for neuropsychopharmacology. Neuropsychopharmacology [Internet]. 2000 Feb;22(2):108–24. Available from: http://www.ncbi.nlm.nih.gov/pubmed/10649824
17. McEwen BS. Stress, adaptation, and disease. Allostasis and allostatic load. Ann N Y Acad Sci [Internet]. 1998 May 1;840:33–44. Available from: http://www.ncbi.nlm.nih.gov/pubmed/9629234
18. McEwen BS, Wingfield JC. What is in a name? Integrating homeostasis, allostasis and stress. Hormones and Behavior. 2010.
19. McEwen BS. Protection and damage from acute and chronic stress: allostasis and allostatic overload and relevance to the pathophysiology of psychiatric disorders. Ann N Y Acad Sci [Internet]. 2004 Dec;1032:1–7. Available from: http://www.ncbi.nlm.nih.gov/pubmed/15677391
20. Fava GA, McEwen BS, Guidi J, Gostoli S, Offidani E, Sonino N. Clinical characterization of allostatic overload. Psychoneuroendocrinology [Internet]. 2019 Oct;108:94–101. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0306453019301581
21. Dowd JB, Simanek AM, Aiello AE. Socio-economic status, cortisol and allostatic load: a review of the literature. Int J Epidemiol [Internet]. 2009 Oct 1;38(5):1297–309. Available from: https://academic.oup.com/ije/article-lookup/doi/10.1093/ije/dyp277
22. Juster R-P, Russell JJ, Almeida D, Picard M. Allostatic load and comorbidities: A mitochondrial, epigenetic, and evolutionary perspective. Dev Psychopathol [Internet]. 2016 Nov 14;28(4pt1):1117–46. Available from: https://www.cambridge.org/core/product/identifier/S0954579416000730/type/journal_article
23. McEwen BS. Allostasis and the Epigenetics of Brain and Body Health Over the Life Course. JAMA Psychiatry [Internet]. 2017 Jun 1;74(6):551. Available from: http://archpsyc.jamanetwork.com/article.aspx?doi=10.1001/jamapsychiatry.2017.0270
24. Casavant SG, Cong X, Fitch RH, Moore J, Rosenkrantz T, Starkweather A. Allostatic Load and Biomarkers of Stress in the Preterm Infant: An Integrative Review. Biol Res Nurs [Internet]. 2019 Mar 17;21(2):210–23. Available from: http://journals.sagepub.com/doi/10.1177/1099800418824415
25. Hunter RG, Seligsohn M, Rubin TG, Griffiths BB, Ozdemir Y, Pfaff DW, et al. Stress and corticosteroids regulate rat hippocampal mitochondrial DNA gene expression via the glucocorticoid receptor. Proc Natl Acad Sci [Internet]. 2016 Aug 9;113(32):9099–104. Available from: http://www.pnas.org/lookup/doi/10.1073/pnas.1602185113
26. Zalli A, Carvalho LA, Lin J, Hamer M, Erusalimsky JD, Blackburn EH, et al. Shorter telomeres with high telomerase activity are associated with raised allostatic load and impoverished psychosocial resources. Proc Natl Acad Sci [Internet]. 2014 Mar 25;111(12):4519–24. Available from: http://www.pnas.org/cgi/doi/10.1073/pnas.1322145111
27. McEwen BS. Neurobiological and Systemic Effects of Chronic Stress. Chronic Stress [Internet]. 2017 Jan 10;1:247054701769232. Available from: http://journals.sagepub.com/doi/10.1177/2470547017692328
28. Martinez-Lavin M, Vargas A. Complex Adaptive Systems Allostasis in Fibromyalgia. Rheum Dis Clin North Am [Internet]. 2009 May;35(2):285–98. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0889857X09000234
29. Beckie TM. A Systematic Review of Allostatic Load, Health, and Health Disparities. Biol Res Nurs [Internet]. 2012 Oct 23;14(4):311–46. Available from: http://journals.sagepub.com/doi/10.1177/1099800412455688
30. Almeer RS, Kassab RB, AlBasher GI, Alarifi S, Alkahtani S, Ali D, et al. Royal jelly mitigates cadmium-induced neuronal damage in mouse cortex. Mol Biol Rep [Internet]. 2019 Feb 9;46(1):119–31. Available from: http://link.springer.com/10.1007/s11033-018-4451-x
31. Pyrzanowska J, Piechal A, Blecharz-Klin K, Joniec-Maciejak I, Graikou K, Chinou I, et al. Long-term administration of Greek Royal Jelly improves spatial memory and influences the concentration of brain neurotransmitters in naturally aged Wistar male rats. J Ethnopharmacol [Internet]. 2014 Aug;155(1):343–51. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0378874114004012
32. Teixeira RR, de Souza AV, Peixoto LG, Machado HL, Caixeta DC, Vilela DD, et al. Royal jelly decreases corticosterone levels and improves the brain antioxidant system in restraint and cold stressed rats. Neurosci Lett [Internet]. 2017 Aug;655:179–85. Available from: https://linkinghub.elsevier.com/retrieve/pii/S030439401730561X
33. Asari MA, Zulkaflee MH, Sirajudeen KNS, Mohd Yusof NA, Mohd Sairazi NS. Tualang honey and DHA-rich fish oil reduce the production of pro-inflammatory cytokines in the rat brain following exposure to chronic stress. J Taibah Univ Med Sci [Internet]. 2019 Aug;14(4):317–23. Available from: https://linkinghub.elsevier.com/retrieve/pii/S1658361219300770
34. Lee W-R, Park J-H, Kim K-H, Park Y-Y, Han S-M, Park K. Protective effects of melittin on transforming growth factor-β1 injury to hepatocytes via anti-apoptotic mechanism. Toxicol Appl Pharmacol [Internet]. 2011 Oct;256(2):209–15. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0041008X11003103
35. Alleva R, Manzella N, Gaetani S, Ciarapica V, Bracci M, Caboni MF, et al. Organic honey supplementation reverses pesticide-induced genotoxicity by modulating DNA damage response. Mol Nutr Food Res [Internet]. 2016 Oct;60(10):2243–55. Available from: http://doi.wiley.com/10.1002/mnfr.201600005
36. Takahashi Y, Hijikata K, Seike K, Nakano S, Banjo M, Sato Y, et al. Effects of Royal Jelly Administration on Endurance Training-Induced Mitochondrial Adaptations in Skeletal Muscle. Nutrients [Internet]. 2018 Nov 12;10(11):1735. Available from: http://www.mdpi.com/2072-6643/10/11/1735
37. Wu X, Zhao B, Cheng Y, Yang Y, Huang C, Meng X, et al. Melittin induces PTCH1 expression by down-regulating MeCP2 in human hepatocellular carcinoma SMMC-7721 cells. Toxicol Appl Pharmacol [Internet]. 2015 Oct;288(1):74–83. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0041008X15300363
38. Doğanyiğit Z, Küp FÖ, Silici S, Deniz K, Yakan B, Atayoglu T. Protective effects of propolis on female rats’ histopathological, biochemical and genotoxic changes during LPS induced endotoxemia. Phytomedicine [Internet]. 2013 May;20(7):632–9. Available from: https://linkinghub.elsevier.com/retrieve/pii/S094471131300041X
39. Khalil MI, Tanvir EM, Afroz R, Sulaiman SA, Gan SH. Cardioprotective Effects of Tualang Honey: Amelioration of Cholesterol and Cardiac Enzymes Levels. Biomed Res Int [Internet]. 2015;2015:1–8. Available from: http://www.hindawi.com/journals/bmri/2015/286051/
40. Prior RL, Cao G. In vivo total antioxidant capacity: comparison of different analytical methods. Free Radic Biol Med [Internet]. 1999 Dec;27(11–12):1173–81. Available from: http://www.ncbi.nlm.nih.gov/pubmed/10641708
41. Bankova V, Galabov AS, Antonova D, Vilhelmova N, Di Perri B. Chemical composition of Propolis Extract ACF® and activity against herpes simplex virus. Phytomedicine [Internet]. 2014 Sep;21(11):1432–8. Available from: http://linkinghub.elsevier.com/retrieve/pii/S0944711314002104
42. Fratellone PM, Tsimis F, Fratellone G. Apitherapy Products for Medicinal Use. J Altern Complement Med. 2016;5(6):6–7.
43. Campos MGR, Bogdanov S, de Almeida-Muradian LB, Szczesna T, Mancebo Y, Frigerio C, et al. Pollen composition and standardisation of analytical methods. Vol. 47, Journal of Apicultural Research. 2008. p. 154–61.
44. Shin S, Ye M, Choi S, Park K. Anti-inflammatory effect of bee venom in an allergic chronic rhinosinusitis mouse model. Mol Med Rep [Internet]. 2018 Mar 9; Available from: http://www.spandidos-publications.com/10.3892/mmr.2018.8720
45. Choi K, Hwang C, Gu S, Park M, Kim J, Park J, et al. Cancer Cell Growth Inhibitory Effect of Bee Venom via Increase of Death Receptor 3 Expression and Inactivation of NF-kappa B in NSCLC Cells. Toxins (Basel) [Internet]. 2014 Jul 25;6(8):2210–28. Available from: http://www.mdpi.com/2072-6651/6/8/2210
46. Yang X-Y, Yang D, Wei-Zhang, Wang J-M, Li C-Y, Hui-Ye, et al. 10-Hydroxy-2-decenoic acid from Royal jelly: a potential medicine for RA. J Ethnopharmacol [Internet]. 2010 Mar 24;128(2):314–21. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20138211
47. Nie J, Chang Y, Li Y, Zhou Y, Qin J, Sun Z, et al. Caffeic Acid Phenethyl Ester (Propolis Extract) Ameliorates Insulin Resistance by Inhibiting JNK and NF-κB Inflammatory Pathways in Diabetic Mice and HepG2 Cell Models. J Agric Food Chem [Internet]. 2017 Oct 18;65(41):9041–53. Available from: https://pubs.acs.org/doi/10.1021/acs.jafc.7b02880
48. Li Q, Verma IM. NF-κB regulation in the immune system. Nat Rev Immunol [Internet]. 2002 Oct;2(10):725–34. Available from: http://www.nature.com/articles/nri910
49. Albensi BC. What Is Nuclear Factor Kappa B (NF-κB) Doing in and to the Mitochondrion? Front Cell Dev Biol [Internet]. 2019 Aug 7;7. Available from: https://www.frontiersin.org/article/10.3389/fcell.2019.00154/full
50. Nasir NFM, Kannan TP, Sulaiman SA, Shamsuddin S, Azlina A, Stangaciu S. The relationship between telomere length and beekeeping among Malaysians. Age (Omaha). 2015;37(3).
