En las últimas décadas ha ocurrido el incremento en la población mundial y la expectativa de vida. Durante el último siglo la población mundial se cuadriplicó y las estimaciones indican que en las próximas décadas se duplicará nuevamente (1). Así mismo la esperanza de vida ha mostrado incrementarse de forma significativa, antes del año 1800 se situaba en los 32 años, en países como Suecia para el año 1900 se encontraba en los 50 años y en la actualidad se estima en los 82 años (2,3).

Las dinámicas demográficas, cambiantes de acuerdo con las poblaciones, muestran diferentes escenarios, de acuerdo con las tasas de natalidad, mortalidad y expectativa de vida. Los países desarrollados muestran en general bajas tasas de natalidad y una mayor expectativa de vida, lo cual conduce a tener una población mayor de 40 años cada vez mayor. Por su puesto muchos países aún se encuentran en este proceso de transición (4,5). Esto, sumado a los avances tecnológicos, médicos y la mejoría en las condiciones de vida de las personas, ha modificado el perfil de enfermedades que se presentan en las poblaciones (6,7). Es decir, cada vez existen una población más envejecida en todo el mundo.
Existen algunas aproximaciones al concepto del envejecimiento. Se ha definido el envejecimiento como aquel proceso que conduce al deterioro persistente en los componentes que se encargan de mantener el estado natural del cuerpo debido al deterioro fisiológico (8). También se le ha definido como el proceso de deterioro progresivo de la función fisiológica que dirige a un incremento de la mortalidad dependiente de la edad (9). Son varios los elementos importantes que surgen de estas definiciones: capacidad funcional, aparición de enfermedades y mortalidad dependiente de la edad. Ellas entonces, definen el envejecimiento como etapa de la vida sin embargo es claro que no comienza a la misma edad cronológica (años cumplidos) en todas las personas.
En una investigación reciente se intentó evaluar la edad comienza el proceso de envejecimiento del cuerpo mediante la medición de la actividad y expresión de diversas proteínas relacionadas con el envejecimiento, siendo evidente que en promedio los 34 años es la edad en la cual comienza (10). Existe por supuesto en algunos casos la discordancia entre la edad cronológica y la edad biológica, es decir la edad identificable de acuerdo con el estado del cuerpo. La evaluación de las metilaciones del ADN mitocondrial y nuclear es un método empleado en la actualidad para evaluar el envejecimiento y sirve como predictor de mortalidad (11). El envejecimiento prematuro deteriora la calidad de vida y está relacionada con el desarrollo de diversas enfermedades y sus desenlaces (12).
Procesos biológicos implicados en el envejecimiento
Existen diversas teorías que intentan explicar el origen del envejecimiento. Estas pueden clasificarse en tres grupos: deterministas (sólo mediante el estudio de los genes es posible explicar el envejecimiento, por ejemplo), estocásticas (diversos factores al azar explican el envejecimiento) y teorías mixtas (13). Lo cierto es que sólo mediante la combinación de diversos procesos fisiológicos y patológicos es posible explicar todos los eventos que ocurren en el envejecimiento. A continuación, se abordan varios de los procesos implicados en el proceso de envejecimiento:
Factores genéticos. Los procesos de división celular a lo largo del tiempo, la exposición a traumas, sobrecarga alostásica y agentes químicos y físicos conduce al desarrollo de mutaciones en el ADN que alteran el funcionamiento celular (14). El estudio de la progreria ha permitido identificar genes de relevancia en la explicación del envejecimiento:
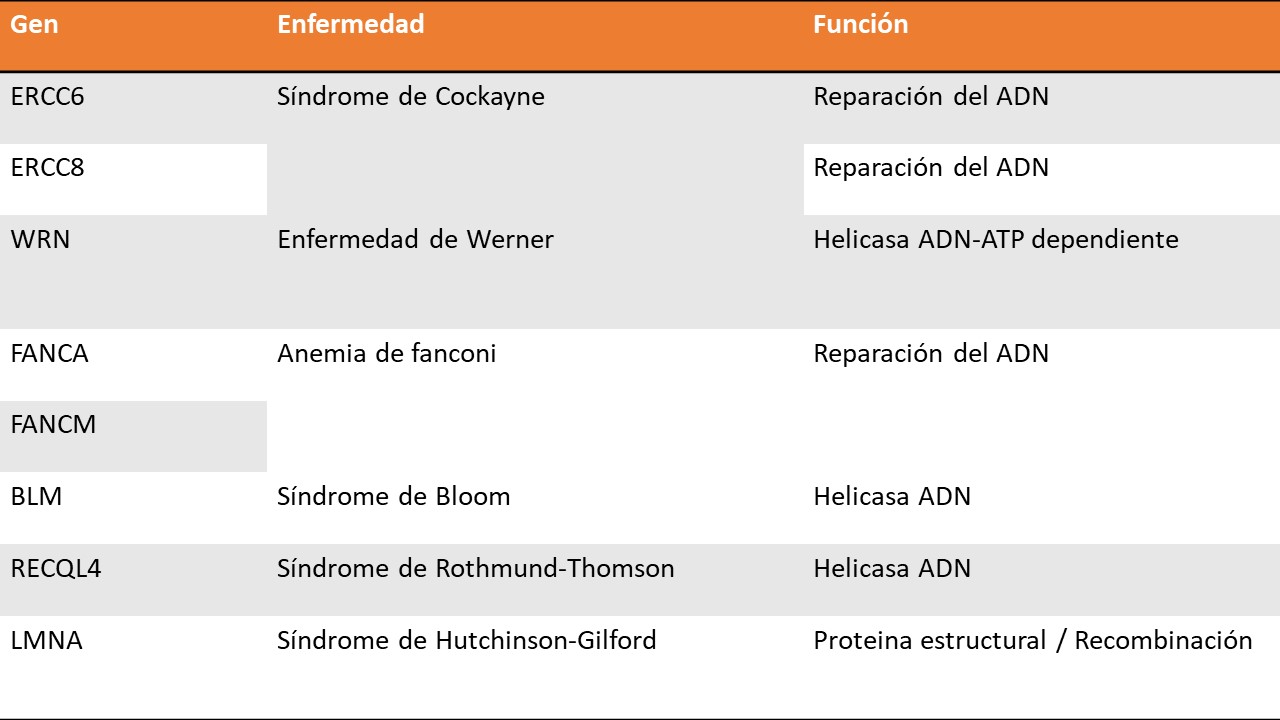
Acortamiento de los telómeros. Los telómeros dan estabilidad a la información genética y con el paso del tiempo se acortan de forma progresiva y significativa. Este proceso esta relacionado con la velocidad con la que se produce el envejecimiento (15). También se ha establecido que un menor tamaño de los telómeros esta relacionado con una mayor mortalidad por todas las causas (16).
Lesión del ADN mitocondrial. Las lesiones del ADN mitocondrial producto de la acción de radicales libres, mutaciones acumuladas a lo largo de la vida y alteraciones en los procesos de fusión y fisión mitocondrial están relacionados con la edad biológica, con una menor longitud de los telómeros y con los cambios fenotípicos del envejecimiento (17).
Hiperactivación del factor nuclear Kappa Beta. Las células senescentes muestran activación exagerada del factor nuclear Kappa Beta lo cual conduce a la pérdida funcional y destrucción de los tejidos e inflamación sistémica (18).
Radicales libres. Los radicales libres estan implicados en el envejecimiento por la inducción de muerte celular que producen, la generación de mutaciones y la alteración funcional (19).
Uniones cruzadas de estructuras celulares. Los procesos de glicación afectan las estructuras celulares, modifican la matriz extracelular y afectan la función de los órganos y tejidos. Estos procesos estan relacionados con una mayor velocidad de envejecimiento (20).
Sistema inmunológico. Con el incremento de la edad son muchas las células del sistema inmunológico senescentes. Esto produce disminución del repertorio de células B y T, disminución de su respuesta y alteraciones en la liberación de citoquinas necesarias para la comunicación con otros grupos celulares (21).
Epigenética. Los procesos de metilación afectan al nucleosoma y la forma en la cual se almacena el ADN alterando la expresión de diferentes proteínas. Una mayor metilación esta relacionada a su vez con la velocidad con la cual ocurre el envejecimiento (22).
Uso de la apiterapia en el envejecimiento
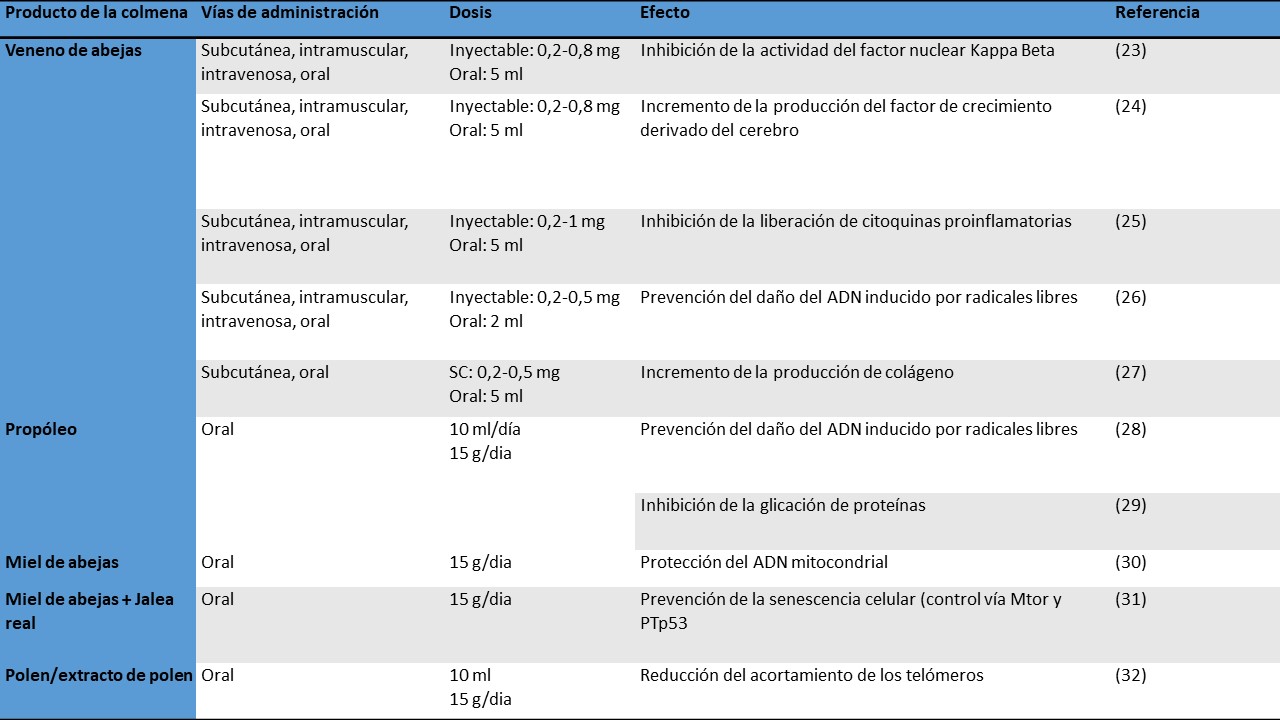
Los productos de la colmena son de gran utilidad en el proceso del envejecimiento. Son varios los mecanismos a través de los cuales actúan:
Referencias bibliográficas
1. Vilches A., Gil Pérez D., Toscano J.C., Macías O. Crecimiento demográfico y Sostenibilidad. Oei. 2018.
2. Herce JA. El impacto del envejecimiento de la población en España. Cuad Inf Económica. 2016;
3. Bezrukov V, Foigt NA. Longevidad centenaria en Europa. Revista Espanola de Geriatria y Gerontologia. 2005.
4. Miró G. C. Transición demográfica y envejecimiento demográfico. Papeles de población. 2003;
5. Chackiel J. La dinámica demográfica en América Latina. Población y Desarro. 2004;
6. Luis Arredondo García J, Nora Carranza Rodríguez M, Margarita Vázquez Cruz Q, Ángel Rodríguez Weber M. Transición epidemiológica. Acta Pediatr Méx. 2003.
7. Ramos-Clason EC. Transición epidemiológica en Colombia: de las enfermedades infecciosas a las no transmisibles. Rev Ciencias Biomédicas. 2012;
8. Galloway A. The evolutionary biology of aging. By Michael R. Rose. New York: Oxford University Press. 1991. ix + 221 pp. ISBN 0-19-506133-0. $35.00 (cloth). Am J Phys Anthropol [Internet]. 1993 Jun;91(2):260–2. Available from: http://doi.wiley.com/10.1002/ajpa.1330910217
9. Fabian DK, Flatt T. The evolution of Aging. Nat Educ Knowl. 2011;3(10):9.
10. Lehallier B, Gate D, Schaum N, Nanasi T, Lee SE, Yousef H, et al. Undulating changes in human plasma proteome profiles across the lifespan. Nat Med [Internet]. 2019 Dec 5;25(12):1843–50. Available from: http://www.nature.com/articles/s41591-019-0673-2
11. Jazwinski SM, Kim S. Metabolic and Genetic Markers of Biological Age. Front Genet [Internet]. 2017 May 23;8. Available from: http://journal.frontiersin.org/article/10.3389/fgene.2017.00064/full
12. Seco M, B. Edelman JJ, Forrest P, Ng M, Wilson MK, Fraser J, et al. Geriatric Cardiac Surgery: Chronology vs. Biology. Hear Lung Circ [Internet]. 2014 Sep;23(9):794–801. Available from: https://linkinghub.elsevier.com/retrieve/pii/S1443950614001814
13. Semsei I. On the nature of aging. Mech Ageing Dev [Internet]. 2000 Aug;117(1–3):93–108. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0047637400001470
14. Ren J, Zhang Y. Genetics and Epigenetics in Aging and Longevity: Myths and Truths. Biochim Biophys Acta – Mol Basis Dis [Internet]. 2019 Jul;1865(7):1715–7. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0925443919300572
15. Rizvi S, Raza ST, Mahdi F. Telomere Length Variations in Aging and Age-Related Diseases. Curr Aging Sci [Internet]. 2015 Mar 2;7(3):161–7. Available from: http://www.eurekaselect.com/openurl/content.php?genre=article&issn=1874-6098&volume=7&issue=3&spage=161
16. Arbeev KG, Verhulst S, Steenstrup T, Kark JD, Bagley O, Kooperberg C, et al. Association of Leukocyte Telomere Length With Mortality Among Adult Participants in 3 Longitudinal Studies. JAMA Netw Open [Internet]. 2020 Feb 26;3(2):e200023. Available from: https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2761863
17. Dolcini J, Wu H, Nwanaji-Enwerem JC, Kiomourtozlogu M-A, Cayir A, Sanchez-Guerra M, et al. Mitochondria and aging in older individuals: an analysis of DNA methylation age metrics, leukocyte telomere length, and mitochondrial DNA copy number in the VA normative aging study. Aging (Albany NY) [Internet]. 2020 Feb 2;12(3):2070–83. Available from: http://www.aging-us.com/article/102722/text
18. Tornatore L, Thotakura AK, Bennett J, Moretti M, Franzoso G. The nuclear factor kappa B signaling pathway: integrating metabolism with inflammation. Trends Cell Biol [Internet]. 2012 Nov;22(11):557–66. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0962892412001407
19. Davinelli S, Bertoglio JC, Polimeni A, Scapagnini G. Cytoprotective Polyphenols Against Chronological Skin Aging and Cutaneous Photodamage. Curr Pharm Des [Internet]. 2018 Apr 5;24(2):99–105. Available from: http://www.eurekaselect.com/156953/article
20. Simm A, Müller B, Nass N, Hofmann B, Bushnaq H, Silber R-E, et al. Protein glycation — Between tissue aging and protection. Exp Gerontol [Internet]. 2015 Aug;68:71–5. Available from: https://linkinghub.elsevier.com/retrieve/pii/S053155651400360X
21. Sadighi Akha AA. Aging and the immune system: An overview. J Immunol Methods [Internet]. 2018 Dec;463:21–6. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0022175917304878
22. Pal S, Tyler JK. Epigenetics and aging. Sci Adv [Internet]. 2016 Jul 29;2(7):e1600584. Available from: https://advances.sciencemag.org/lookup/doi/10.1126/sciadv.1600584
23. Gu SM, Park MH, Hwang CJ, Song HS, Lee US, Han SB, et al. Bee venom ameliorates lipopolysaccharide-induced memory loss by preventing NF-kappaB pathway. J Neuroinflammation [Internet]. 2015 Dec 26;12(1):124. Available from: http://www.jneuroinflammation.com/content/12/1/124
24. Cai M, Lee JH, Yang EJ. Bee Venom Ameliorates Cognitive Dysfunction Caused by Neuroinflammation in an Animal Model of Vascular Dementia. Mol Neurobiol [Internet]. 2017 Oct 29;54(8):5952–60. Available from: http://link.springer.com/10.1007/s12035-016-0130-x
25. Jang H-S, Kim SK, Han J-B, Ahn H-J, Bae H, Min B-I. Effects of bee venom on the pro-inflammatory responses in RAW264.7 macrophage cell line. J Ethnopharmacol [Internet]. 2005 May;99(1):157–60. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0378874105001996
26. Kocyigit A, Guler EM, Kaleli S. Anti-inflammatory and antioxidative properties of honey bee venom on Freund’s Complete Adjuvant-induced arthritis model in rats. Toxicon [Internet]. 2019 Apr;161:4–11. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0041010119300571
27. Hozzein WN, Badr G, Badr BM, Allam A, Ghamdi A Al, Al-Wadaan MA, et al. Bee venom improves diabetic wound healing by protecting functional macrophages from apoptosis and enhancing Nrf2, Ang-1 and Tie-2 signaling. Mol Immunol [Internet]. 2018;103:322–35. Available from: http://www.ncbi.nlm.nih.gov/pubmed/30366166
28. Abd‐Elrazek AM, El‐dash HA, Said NI. The role of propolis against paclitaxel‐induced oligospermia, sperm abnormality, oxidative stress and DNA damage in testes of male rats. Andrologia [Internet]. 2020 Feb 25;52(1). Available from: https://onlinelibrary.wiley.com/doi/abs/10.1111/and.13394
29. Lee E-J, Kang M-K, Kim D, Kim Y-H, Oh H, Kang Y-H. Chrysin Inhibits Advanced Glycation End Products-Induced Kidney Fibrosis in Renal Mesangial Cells and Diabetic Kidneys. Nutrients [Internet]. 2018 Jul 9;10(7):882. Available from: http://www.mdpi.com/2072-6643/10/7/882
30. Cruz LC, Ecker A, Rodrigues NR, Martins IK, Posser T, Maciel FE, et al. Honey protects against wings posture error and molecular changes related to mitochondrial pathways induced by hypoxia/reoxygenation in adult Drosophila melanogaster. Chem Biol Interact [Internet]. 2018 Aug;291:245–52. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0009279717313509
31. Jiang C, Liu X, Li C, Qian H, Chen D, Lai C, et al. Anti-senescence effect and molecular mechanism of the major royal jelly proteins on human embryonic lung fibroblast (HFL-I) cell line. J Zhejiang Univ B [Internet]. 2018 Dec 17;19(12):960–72. Available from: http://link.springer.com/10.1631/jzus.B1800257
32. Nasir NFM, Kannan TP, Sulaiman SA, Shamsuddin S, Azlina A, Stangaciu S. The relationship between telomere length and beekeeping among Malaysians. Age (Omaha) [Internet]. 2015 Jun 2;37(3):58. Available from: http://link.springer.com/10.1007/s11357-015-9797-6
