La herencia es el proceso de transmisión de información de los progenitores a su descendencia. Inicialmente se consideró que este proceso era debido meramente a la acción de los genes (unidades funcionales que transmiten información entre generaciones) pero posteriormente se reconoció que la existen otros mecanismos (epigenéticos) de herencia (1).
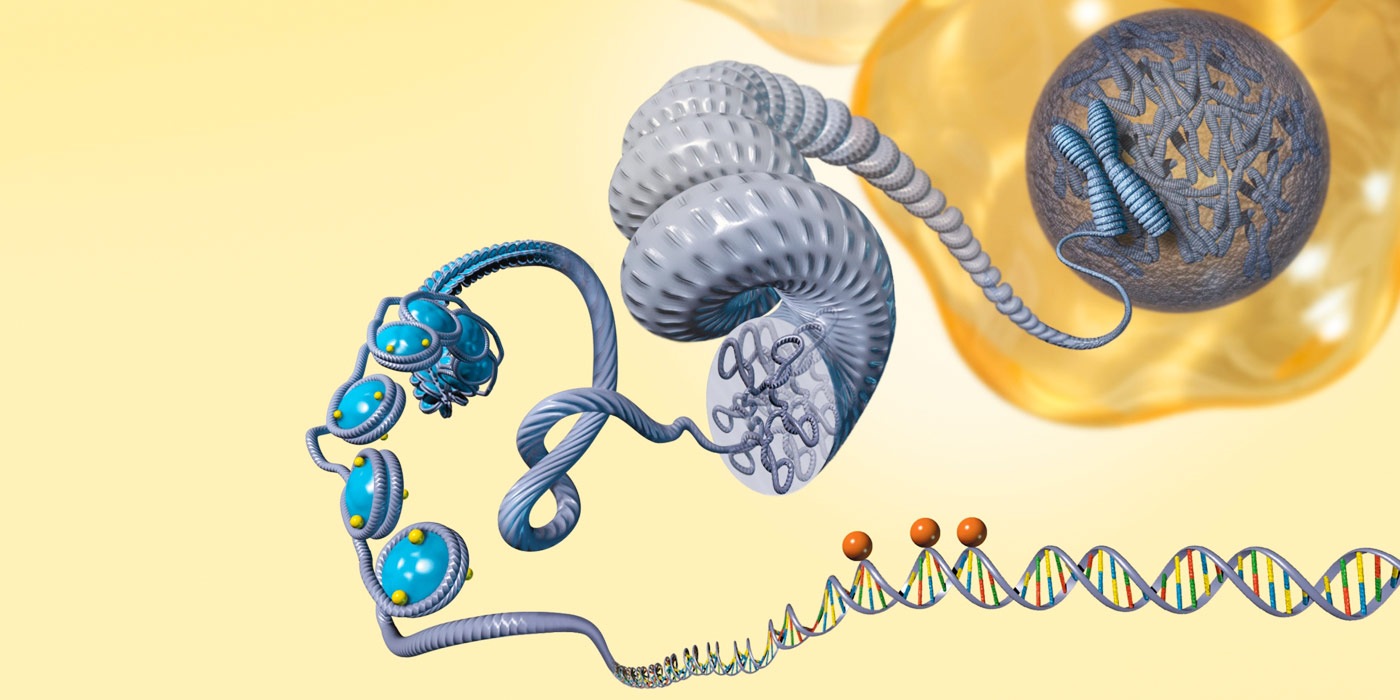
Estos mecanismos no genéticos han cobrado cada vez más importancia porque explican la transmisión de diferentes rasgos de comportamiento, funcionamiento del organismos, fisiología que no se explican por los mecanismos tradicionales de herencia (2).
Mecanismos epigenéticos
Los mecanismos epigenéticos regulan no sólo la herencia entre diferentes generaciones de individuos sino también la forma en la cual se expresan los genes. Es decir, la epigenética modifica la forma en la cual funciona el organismo (3). Dentro de los mecanismos epigenéticos de modificación de la expresión genética se encuentran:
Metilación del ADN. La metilación de secuencias del ADN está relacionada con el silenciamiento de la expresión de genes. La expresión clínica de estas consecuencias se presenta principalmente en genes de proteinas reguladoras del crecimiento y desarrollo celular y el funcionamiento de procesos clave como la reparación tisular (4), este proceso se relaciona también con la memoria intracelular (5).
Acetilación de histonas. Los procesos de acetilación en las histonas modifican la disponibilidad de la información genética en las células. La acetilación de histonas favorece la apertura del ADN lo cual a su vez facilita el acceso de los factores de transcripción como el factor nuclear kappa-beta a muchos genes en muchos casos sin regulación (6).
Metilación de histonas. La metilación de histonas silencia la expresión de ciertos genes, muchos de los identificados son genes supresores tumorales y por tanto se pierde la regulación de la expresión de proteinas necesarias para la regulación el ciclo célula e incluso la regulación del proceso inflamatorio. El cáncer y las enfermedades autoinmunes son condiciones relacionadas con alteraciones en la metilación de las histonas (7).
ARN no codificante. El ARN de interferencia que no codifica para ninguna proteina si posee la capacidad para interferir con la producción de proteínas, es uno de los mecanismos importantes para la regulación negativa de la expresión de proteínas. Su importancia ha sido especialmente manifiesta en la regulación de la expresión de proteínas relacionadas con el crecimiento y desarrollo tumoral y la infección por VIH (8,9).
Regiones reguladoras del ADN. Existen porciones del ADN que no codifican para proteinas, pero si poseen la capacidad de regular la forma en la cual los genes son sometidos al proceso de transcripción. Modificaciones en el plegamiento de la información genética, acortamiento o alargamiento de las regiones reguladoras del ADN modifican la forma en la cual los genes se expresan (10).
Herencia epigenética transgeneracional
Existen tres mecanismos muy importantes de transmisión epigenética de información transgeneracional. Su descubrimiento ha significado, por supuesto, un nuevo entendimiento de todos los mecanismos de herencia de susceptibilidades a diferentes enfermedades:
- Metilación. Un grupo metilo es transferido desde S-adenosilmetionina a una posición C-5 de citosina por una ADN-5 metiltrasferasa (11). La metilación del ADN ocurre principalmente en dinucleótidos CpG, teniendo un importante papel en la regulación de la expresión del gen (12).
- Impronta genética. Son los genes que modifican la expresión de otros genes. Algunos genes se leen de la madre y otros del padre, mecanismos de metilación, acetilación y fosforilación desde el momento de la concepción modifican la forma en la cual se hace más importante un gen u otro, de acuerdo al sexo (13).
- Modificación de histonas. Se incluyen mecanismos de acetilación, metilación y fosforilación (14).
Mediante estos mecanismos se ha explicado la herencia de aspectos como (15–18):
- Capacidad para combatir infecciones
- Respuesta exagerada a estímulos infecciosos o agentes químicos (complicaciones de infecciones o alergias)
- Personalidad
- Inteligencia
- Capacidad para generar memoria
- Susceptibilidad para desarrollar cáncer
- Velocidad de envejecimiento
- Capacidad para el rendimiento físico
La evidencia científica ha mostrado además la herencia epigenética transgeneracional de:
- Hiperreactividad al estrés luego de trauma psicológico. La exposición in útero incrementa la reactividad de la descendencia de forma significativa (19).
- Respuesta del hipocampo a los estrógenos (20).
- Infertilidad masculina (21).
Factores con implicaciones epigenéticas
Diferentes factores poseen impacto directo sobre la herencia epigenética, dentro de estos se encuentran:
- Estrés materno
- Consumo de drogas y alcohol antes y durante el embarazo (madre y padre)
- Maltrato físico y psicológico
- Consumo de alimentos fritos y azúcares refinadas
- Falta de estrategias de afrontamiento ante el estrés
Es claro que la exposición incluso durante la infancia se puede transmitir a las generaciones venideras. El seguimiento ha mostrado que estos rasgos de herencia epigenética pueden transmitirse incluso hasta tres generaciones (22).
Referencias bibliográficas
1. RIVERO CANALEJO S. QUÉ ES LA EPIGENÉTICA. IUS Sci. 2018;
2. Rando OJ, Verstrepen KJ. Timescales of Genetic and Epigenetic Inheritance. Cell. 2007.
3. Jaenisch R, Bird A. Epigenetic regulation of gene expression: How the genome integrates intrinsic and environmental signals. Nature Genetics. 2003.
4. Robertson KD. DNA methylation and human disease. Nature Reviews Genetics. 2005.
5. Bird A. DNA methylation patterns and epigenetic memory. Genes and Development. 2002.
6. Shahbazian MD, Grunstein M. Functions of Site-Specific Histone Acetylation and Deacetylation. Annu Rev Biochem. 2007;
7. Cedar H, Bergman Y. Linking DNA methylation and histone modification: Patterns and paradigms. Nature Reviews Genetics. 2009.
8. Gonzalez-Alegre P. RNA Interference. In: Encyclopedia of Movement Disorders. 2010.
9. Kole R, Krainer AR, Altman S. RNA therapeutics: Beyond RNA interference and antisense oligonucleotides. Nature Reviews Drug Discovery. 2012.
10. Dunham I, Kundaje A, Aldred SF, Collins PJ, Davis CA, Doyle F, et al. An integrated encyclopedia of DNA elements in the human genome. Nature. 2012;
11. McRae AF, Powell JE, Henders AK, Bowdler L, Hemani G, Shah S, et al. Contribution of genetic variation to transgenerational inheritance of DNA methylation. Genome Biol. 2014;
12. Daxinger L, Whitelaw E. Understanding transgenerational epigenetic inheritance via the gametes in mammals. Nature Reviews Genetics. 2012.
13. Szyf M. Nongenetic inheritance and transgenerational epigenetics. Trends in Molecular Medicine. 2015.
14. Gräff J, Mansuy IM. Epigenetic codes in cognition and behaviour. Behavioural Brain Research. 2008.
15. Heard E, Martienssen RA. Transgenerational epigenetic inheritance: Myths and mechanisms. Cell. 2014.
16. Youngson NA, Whitelaw E. Transgenerational Epigenetic Effects. Annu Rev Genomics Hum Genet. 2008;
17. Lim JP, Brunet A. Bridging the transgenerational gap with epigenetic memory. Trends in Genetics. 2013.
18. Rakyan V, Whitelaw E. Transgenerational epigenetic inheritance. Curr Biol. 2003;
19. Harris J. An inheritance of terror: postmemory and transgenerational transmission of trauma in second generation jews after the holocaust. Am J Psychoanal [Internet]. 2020 Mar;80(1):69–84. Available from: http://www.ncbi.nlm.nih.gov/pubmed/32094445
20. Yang Y, Jiang W, Yang S, Qi F, Zhao R. Transgenerational Inheritance of Betaine‐Induced Epigenetic Alterations in Estrogen‐Responsive IGF‐2/IGFBP2 Genes in Rat Hippocampus. Mol Nutr Food Res [Internet]. 2020 Feb 25;1900823. Available from: https://onlinelibrary.wiley.com/doi/abs/10.1002/mnfr.201900823
21. Sadler-Riggleman I, Klukovich R, Nilsson E, Beck D, Xie Y, Yan W, et al. Epigenetic transgenerational inheritance of testis pathology and Sertoli cell epimutations: generational origins of male infertility. Dolinoy D, editor. Environ Epigenetics [Internet]. 2019 Jul 1;5(3). Available from: https://academic.oup.com/eep/article/doi/10.1093/eep/dvz013/5556456
22. Morgan DK, Whitelaw E. The case for transgenerational epigenetic inheritance in humans. Mammalian Genome. 2008.

How do epigenetic mechanisms, such as DNA methylation and histone modification, contribute to the transgenerational transmission of traits and characteristics? Telkom University