El veneno de abejas (VA) o apitoxina es una sustancia de composición compleja. Las primeras abejas, de hecho, no tenían aguijón. Fue sólo cuando ellas comenzaron a almacenar alimentos (miel y polen) que inició el proceso evolutivo de la generación del aguijón y el veneno como mecanismo de defensa contra agresores potenciales (1). El uso del VA con fines terapéuticos remonta a los comienzos mismos de la humanidad, aunque el conocimiento sobre su uso, mecanismos de acción y formas de aplicación se ha incrementado de forma significativa en los últimos años, esto sin duda ha llevado a una reinterpretación de muchas de las prácticas existentes a su aplicación (2).

Dentro de sus componentes se encuentran diferentes proteinas, ácidos y aminas biogénicas:
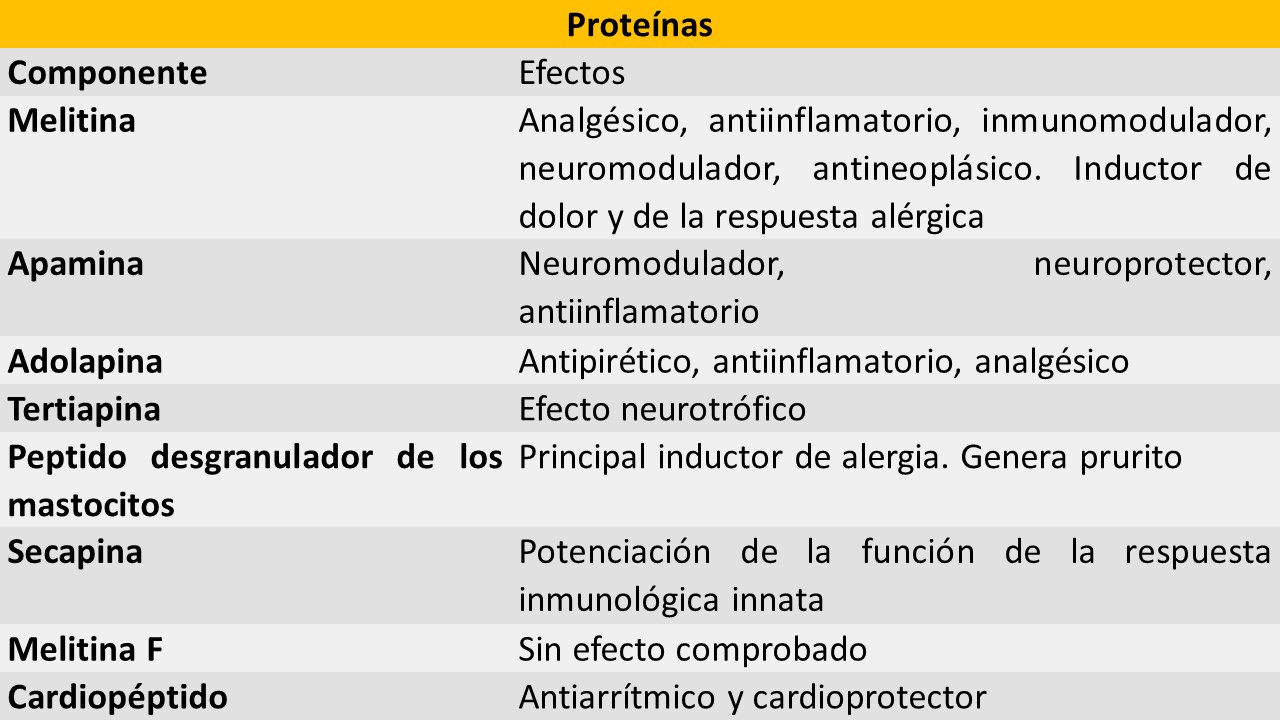
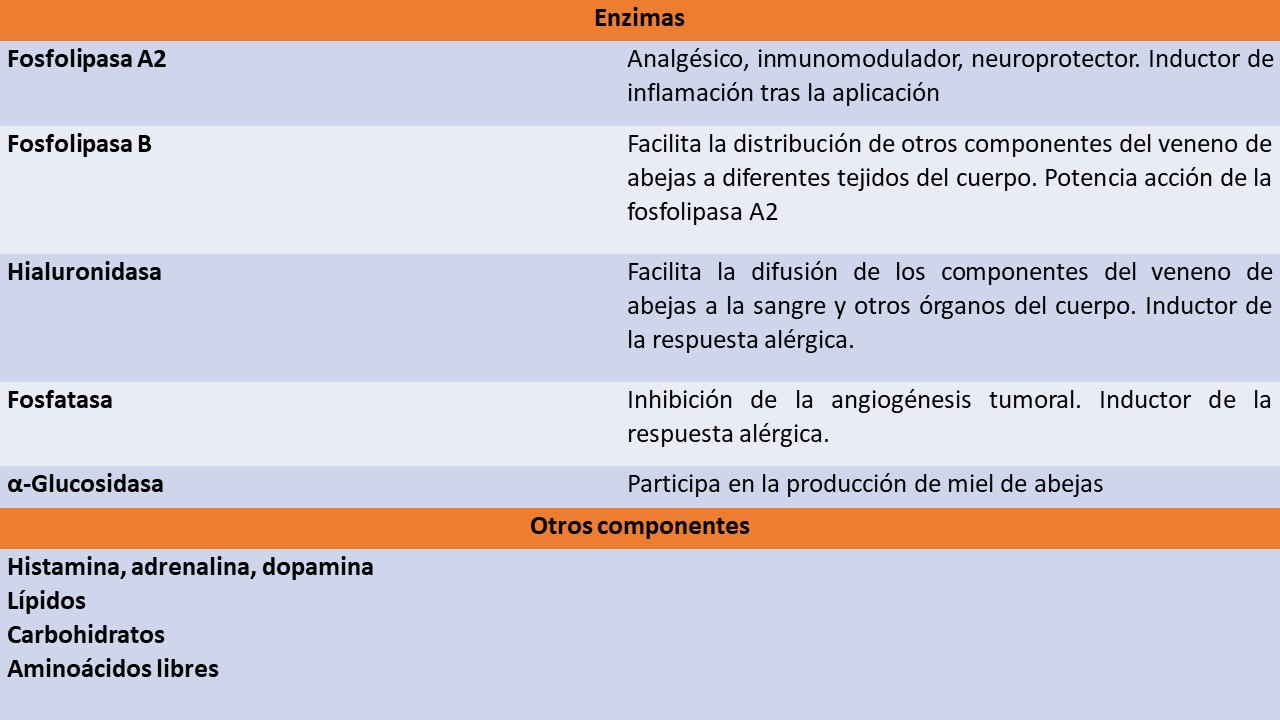
Fuente: Elaboración propia basada en (3–7).
Farmacocinética
El VA puede ser administrado a través de diferentes vías: oral, tópica y parenteral (subcutánea, intravenosa, intradérmica, intramuscular, intraarticular), por supuesto, cada una de las vías de administración utilizadas posee un perfil farmacocinético propio. El VA tiene una amplia distribución tisular y es posible identificarlo, luego de algunos minutos de su administración, en todos los tejidos del cuerpo, incluso, en el sistema nervioso central, las mayores concentraciones se logran especialmente en el hígado y riñón (8). La degradación y metabolismo de los componentes del VA ocurre principalmente por acción de la estearasa plasmática, aunque se ha descrito también la acción de los neumocitos en el metabolismo de sus proteínas. La excreción se da a través de la orina.
Administración oral. La absorción se produce principalmente de forma sublingual, en el intestino delgado y colon (9). El paso del VA por el estómago implica una desnaturalización de algunas de sus proteinas como consecuencia del ambiente ácido, sin embargo, también permite el cambio de protonación de sus proteínas facilitando su posterior absorción en el intestino delgado y colon. En buena medida el proceso de paso de los componentes del veneno de abejas hacia el cuerpo y al interior de las células donde se realizará su actividad terapéutica ocurre como parte de un proceso que no implica gasto energético pero si la integración de estos compuestos en la capa de fosfolípidos, esto gracias al funcionamiento electroquímico de los péptidos que contiene (10). La biodisponibilidad del VA por vía oral es del 10%.
Administración Tópica. El VA puede ingresar al cuerpo gracias a la acción de la hialuronidasa con biodisponibilidad de entre el 10% y 30%, su capacidad para integrarse con la membrana celular facilita su absorción, el ingreso se produce a una baja velocidad lo cual reduce la frecuencia de presentación de reacciones adversas.
Administración inyectable. Tradicionalmente se ha empleado la picadura de la abeja como método para la administración del VA, sin embargo, este no se aconseja actualmente porque no permite el control de la dosis, hay limitación de las vías de administración y existe un mayor riesgo de alergias e infecciones.
Las características farmacocinéticas del VA hacen que sea necesario, para el tratamiento de la mayoría de las enfermedades, del uso de diferentes vías de administración como parte del tratamiento :
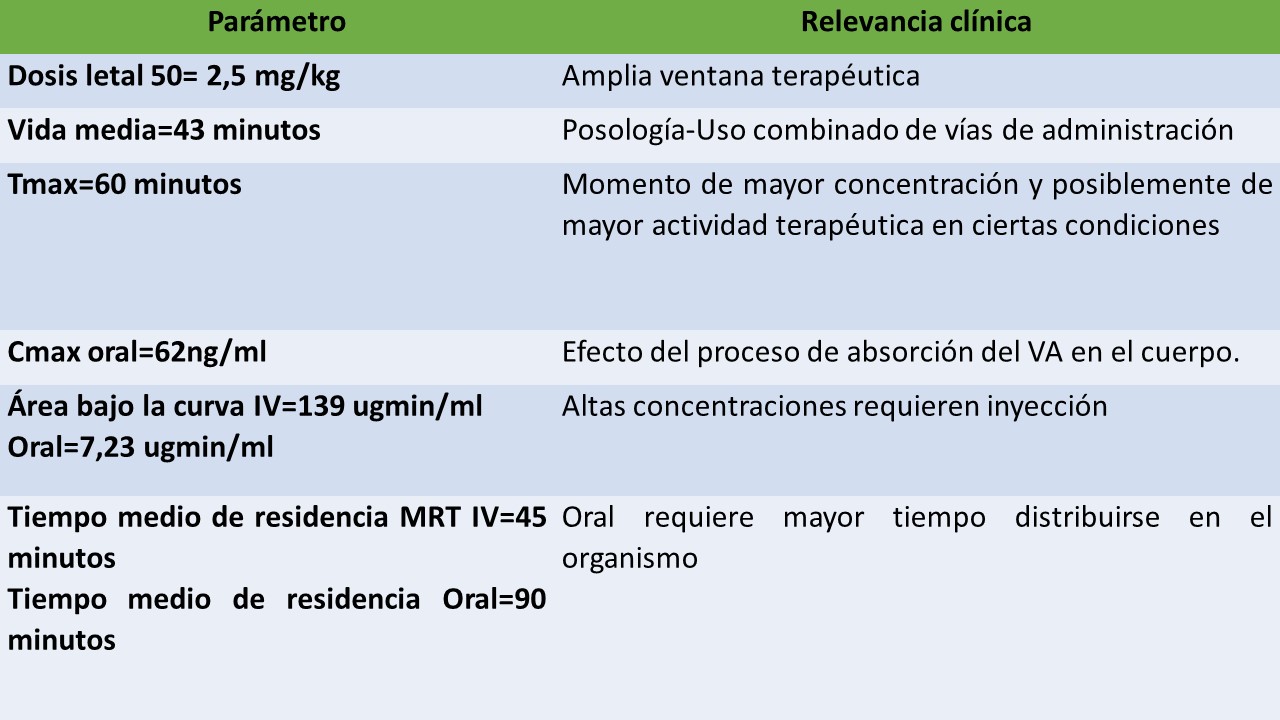
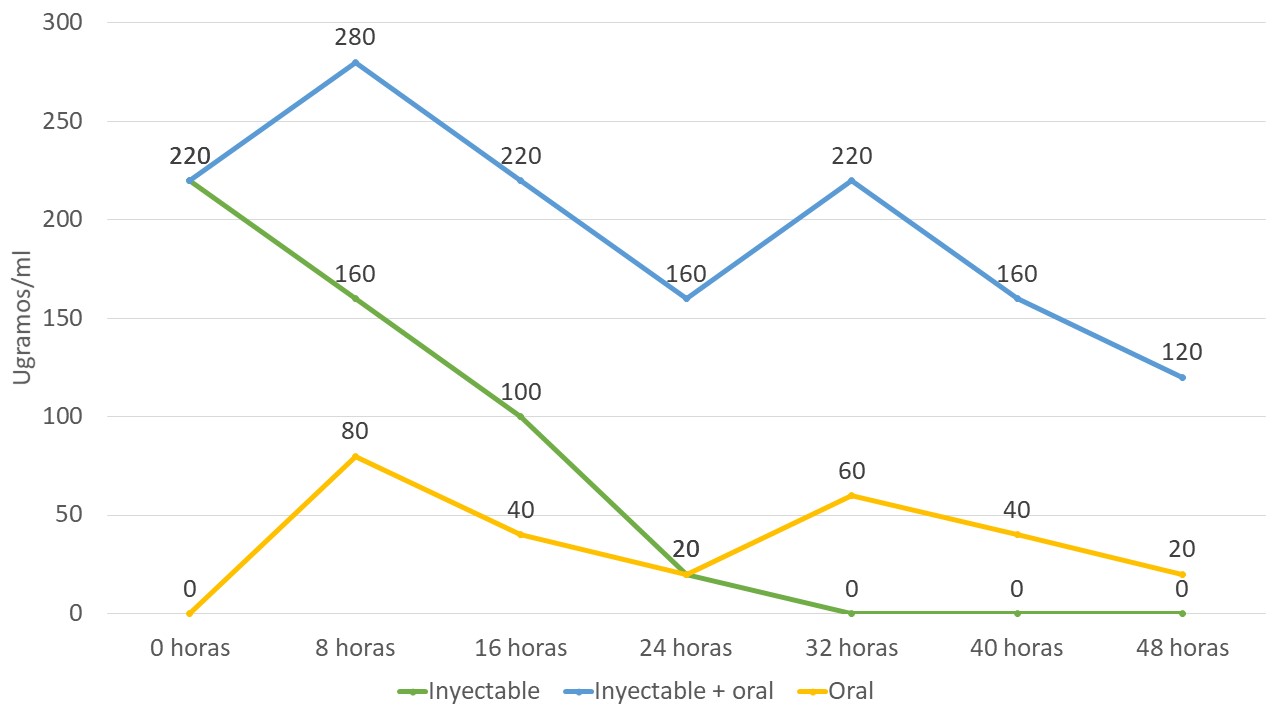
Mecanismos de acción
Los efectos del veneno de abejas pueden agruparse en siete grandes ejes. En la puede verse un resumen de sus efectos y mecanismos de acción.
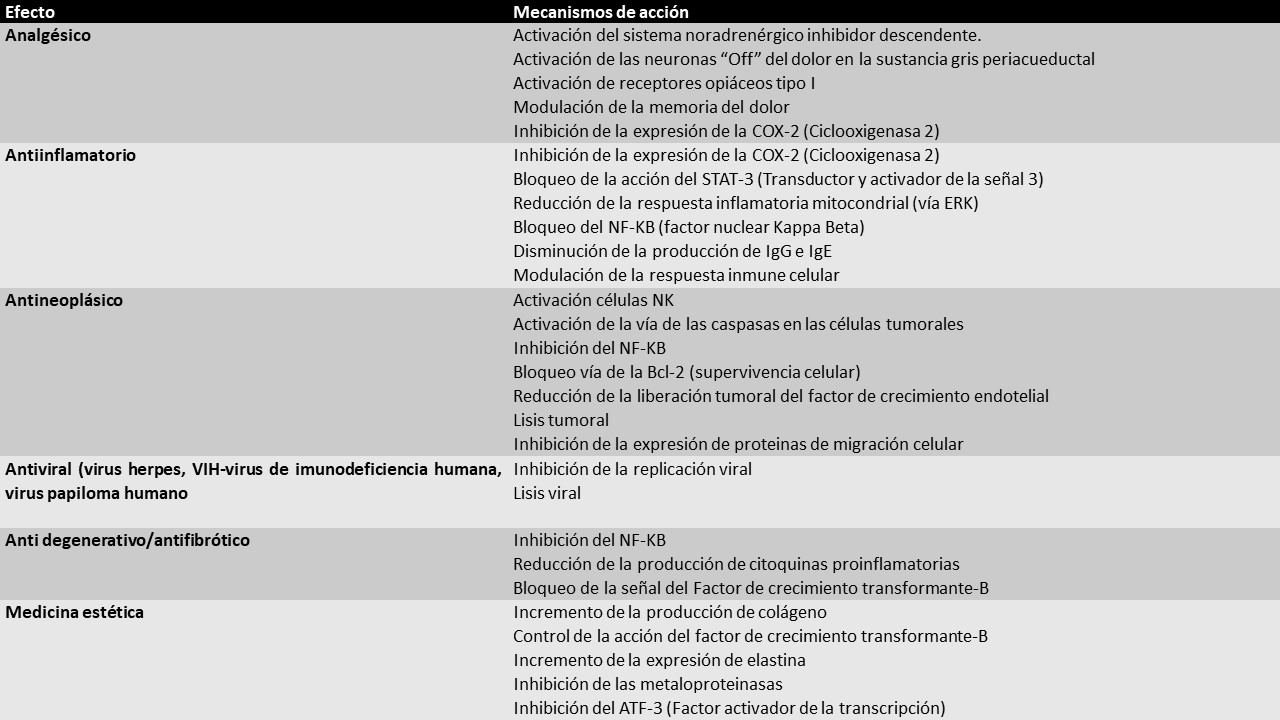
Fuente: Elaboración propia basada en (11–17).
Seguridad
Las vías de administración oral y tópica no suelen provocar eventos secundarios en las personas, la hipersensibilidad por estas vías no se ha descrito en la literatura y de llegar a ocurrir probablemente se genera como consecuencia de excipientes o vehículos empleados en la preparación. La administración inyectable del VA produce con cierta frecuencia eventos adversos, en su mayoría de severidad leve (18). La experiencia acumulada en nuestro servicio ha mostrado que el dolor de tipo ardor, prurito e inflamación son los eventos adversos más frecuentes después de la aplicación y tan sólo en el 10% de los pacientes su intensidad motiva preocupación en ellos.
El VA potencialmente puede producir dos condiciones relevantes desde el punto de vista clínico: alergias y respuesta tóxica. El tema de las alergias será revisado más adelante en otro capítulo sin embargo es buen momento para recordar la importancia de realizar previa a la aplicación del VA la prueba de alergia en todas las personas. La toxicidad o respuesta tóxica se presenta como consecuencia de la acción de los componentes del VA (principalmente fosfolipasa, hialuronidasa y melitina), esta puede presentarse de forma local o sistémica. La forma sistémica no suele presentarse en el contexto de la práctica clínica de la apiterapia y esta descrita en casos de ataques masivos de abejas sobre un individuo. El síndrome de envenenamiento por VA se caracteriza por la presentación de hemolisis, rabdiomilisis y falla hepática y renal aguda, su manejo, por supuesto, es intrahospitalario (19).
La respuesta tóxica local, como su nombre lo indica, se presenta en el o los sitios de aplicación del VA. Esta respuesta se caracteriza por la presencia de dolor e inflamación persistente en el sitio de aplicación, ocasionalmente puede acompañarse de prurito. Es importante tener en cuenta que en algunos casos su intensidad puede emular los hallazgos típicos de la inspección de un cuadro de celulitis (con excepción del incremento de la zona de eritema). La mayoría de los casos remiten sin necesidad de intervención especifica aunque eventualmente puede indicarse el uso de anti inflamatorios no esteroideos o corticoides para mitigar la intensidad sintomática (20–22).
No existen en la literatura descripciones de interacciones del VA con alimentos, suplementos dietarios, nutracéuticos o medicamentos. Desde el punto de vista teórico eventualmente el VA a dosis muy altas (dosis mayores a 0,2 mg/kg) podría generar sobre anticoagulación.
Referencias bibliográficas
1. PACKER L. Comparative morphology of the skeletal parts of the sting apparatus of bees (Hymenoptera: Apoidea). Zool J Linn Soc [Internet]. 2003 May;138(1):1–38. Available from: https://academic.oup.com/zoolinnean/article-lookup/doi/10.1046/j.1096-3642.2003.00055.x
2. Ali M. Studies on bee venom and its medical uses. Int J Adv Res Technol. 2012;
3. Hossen M, Shapla U, Gan S, Khalil M. Impact of Bee Venom Enzymes on Diseases and Immune Responses. Molecules [Internet]. 2016 Dec 27;22(1):25. Available from: http://www.mdpi.com/1420-3049/22/1/25
4. Cornara L, Biagi M, Xiao J, Burlando B. Therapeutic Properties of Bioactive Compounds from Different Honeybee Products. Front Pharmacol [Internet]. 2017 Jun 28;8. Available from: http://journal.frontiersin.org/article/10.3389/fphar.2017.00412/full
5. Lee G, Bae H. Anti-Inflammatory Applications of Melittin, a Major Component of Bee Venom: Detailed Mechanism of Action and Adverse Effects. Molecules [Internet]. 2016 May 11;21(5):616. Available from: http://www.mdpi.com/1420-3049/21/5/616
6. Lee KS, Kim BY, Yoon HJ, Choi YS, Jin BR. Secapin, a bee venom peptide, exhibits anti-fibrinolytic, anti-elastolytic, and anti-microbial activities. Dev Comp Immunol [Internet]. 2016 Oct;63:27–35. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0145305X16301586
7. Pak SC. Chemical Composition of Bee Venom. In: Bee Products – Chemical and Biological Properties [Internet]. Cham: Springer International Publishing; 2017. p. 279–85. Available from: http://link.springer.com/10.1007/978-3-319-59689-1_13
8. Yonamine CM, Costa H, Silva JAA, Muramoto E, Rogero JR, Troncone LRP, et al. Biodistribution studies of bee venom and spider toxin using radiotracers. J Venom Anim Toxins Incl Trop Dis. 2005;
9. Xing L, Liping X, Rongqing Z, Dawei C, Lan S. A sensitive enzyme-linked immunosorbent assay for evaluating the concentration of bee venom in rat plasma. J Pharm Pharmacol [Internet]. 2003 Oct;55(10):1359–63. Available from: http://doi.wiley.com/10.1211/0022357022025
10. Chen CH, Wiedman G, Khan A, Ulmschneider MB. Absorption and folding of melittin onto lipid bilayer membranes via unbiased atomic detail microsecond molecular dynamics simulation. Biochim Biophys Acta – Biomembr [Internet]. 2014 Sep;1838(9):2243–9. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0005273614001473
11. Zhang S, Liu Y, Ye Y, Wang X-R, Lin L-T, Xiao L-Y, et al. Bee venom therapy: Potential mechanisms and therapeutic applications. Toxicon [Internet]. 2018 Jun;148:64–73. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0041010118301454
12. Woo S, Chung G, Bae H, Kim SK. Suppressive Effects of Bee Venom-Derived Phospholipase A2 on Mechanical Allodynia in a Rat Model of Neuropathic Pain. Toxins (Basel) [Internet]. 2019 Aug 19;11(8):477. Available from: https://www.mdpi.com/2072-6651/11/8/477
13. Choi S, Chae HK, Heo H, Hahm D-H, Kim W, Kim SK. Analgesic Effect of Melittin on Oxaliplatin-Induced Peripheral Neuropathy in Rats. Toxins (Basel) [Internet]. 2019 Jul 8;11(7):396. Available from: https://www.mdpi.com/2072-6651/11/7/396
14. Conrad VJ, Hazan LL, Latorre AJ, Jakubowska A, Kim CMH. Efficacy and Safety of Honey Bee Venom ( Apis mellifera) Dermal Injections to Treat Osteoarthritis Knee Pain and Physical Disability: A Randomized Controlled Trial. J Altern Complement Med [Internet]. 2019 Aug;25(8):845–55. Available from: https://www.liebertpub.com/doi/10.1089/acm.2019.0121
15. Lee S, Lee J, Kim Y, Choi J, Jeon S, Kim D, et al. Antiallodynic Effects of Bee Venom in an Animal Model of Complex Regional Pain Syndrome Type 1 (CRPS-I). Toxins (Basel) [Internet]. 2017 Sep 15;9(9):285. Available from: http://www.mdpi.com/2072-6651/9/9/285
16. Ham HJ, Han S-B, Yun J, Yeo IJ, Ham YW, Kim SH, et al. Bee venom phospholipase A2 ameliorates amyloidogenesis and neuroinflammation through inhibition of signal transducer and activator of transcription-3 pathway in Tg2576 mice. Transl Neurodegener [Internet]. 2019 Dec 2;8(1):26. Available from: https://translationalneurodegeneration.biomedcentral.com/articles/10.1186/s40035-019-0167-7
17. Wehbe R, Frangieh J, Rima M, El Obeid D, Sabatier J-M, Fajloun Z. Bee Venom: Overview of Main Compounds and Bioactivities for Therapeutic Interests. Molecules [Internet]. 2019 Aug 19;24(16):2997. Available from: https://www.mdpi.com/1420-3049/24/16/2997
18. Park JH, Yim BK, Lee J-H, Lee S, Kim T-H. Risk Associated with Bee Venom Therapy: A Systematic Review and Meta-Analysis. Gao C-Q, editor. PLoS One [Internet]. 2015 May 21;10(5):e0126971. Available from: http://dx.plos.org/10.1371/journal.pone.0126971
19. Pucca MB, Cerni FA, Oliveira IS, Jenkins TP, Argemí L, Sørensen C V., et al. Bee Updated: Current Knowledge on Bee Venom and Bee Envenoming Therapy. Front Immunol [Internet]. 2019 Sep 6;10. Available from: https://www.frontiersin.org/article/10.3389/fimmu.2019.02090/full
20. Arif F, Williams M. Hymenoptera Stings (Bee, Vespids and Ants) [Internet]. StatPearls. 2019. Available from: http://www.ncbi.nlm.nih.gov/pubmed/30085514
21. Valderrama Hernández R. Aspectos toxinológicos y biomédicos del veneno de las abejas Apis mellifera. Iatreia. 2003.
22. Valderrama R. Envenenamientos causados por picaduras de himenópteros abejas, avispas y hormigas. In: Aspectos toxinológicos y biomédicos del veneno de las abejas Apis mellifera. 2003. p. 217–27.

How does the pharmacokinetic profile of bee venom vary across different administration routes, and what are the safety considerations for each route? Telkom University